现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有Cu0粉末)中金属铜的含量。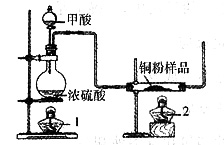
(1)制备一氧化碳的化学方程式是______。
(2)实验中,观察到反应管中发生的现象是______,尾气的主要成分是______。
(3)反应完成后,正确的操作顺序为______(填字母)。
a.关闭漏斗开关; b.熄灭酒精灯1; c.熄灭酒精灯2
(4)若实验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为______。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案:
①设计方案的主要步骤是(不必描述操作过程的细节)
②写出有关反应的化学方程式______。
参考答案:
(1)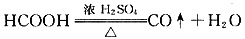
(2)样品粉末逐渐变为红色CO、CO2
(3)cab
(4)80%
(5)①将浓硫酸稀释;称取一定量的样品;样品与过量稀硫酸充分反应;过滤、洗涤;干燥、称重、计算
②
答案解释: 本题涉及化学实验基本操作,涉及常规实验的实验原理、实验现象、实验基本操作、实验数据处理等问题。
(1)实验室常将甲酸和浓硫酸混合加热来制取CO,
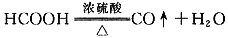 。
。
(2)反应管中是铜(红色)和氧化铜(黑色)的混合物,反应中逐渐变为红色的铜,尾气的主要成分为CO和CO2。
(3)反应前和反应完成后点燃酒精灯和熄灭酒精灯的操作顺序事关实验安全问题,反应完成后应按c、a、b的顺序操作。
(4)反应前后固体物质的质量差为5.0g-4.8g=0.2g,即原混合物中氧化铜中氧原子的质量为0.2g,则原混合物中氧化铜为1g,即金属铜的质量分数为80%。
(5)从所给试剂来看,易于操作,且实验效果较好的是:将浓硫酸稀释后,用过量稀硫酸与样品反应,过滤、洗涤、干燥、称量、计算。
解析:
本题涉及化学实验基本操作,涉及常规实验的实验原理、实验现象、实验基本操作、实验数据处理等问题。
(1)实验室常将甲酸和浓硫酸混合加热来制取CO,
 。
。
(2)反应管中是铜(红色)和氧化铜(黑色)的混合物,反应中逐渐变为红色的铜,尾气的主要成分为CO和CO2。
(3)反应前和反应完成后点燃酒精灯和熄灭酒精灯的操作顺序事关实验安全问题,反应完成后应按c、a、b的顺序操作。
(4)反应前后固体物质的质量差为5.0g-4.8g=0.2g,即原混合物中氧化铜中氧原子的质量为0.2g,则原混合物中氧化铜为1g,即金属铜的质量分数为80%。
(5)从所给试剂来看,易于操作,且实验效果较好的是:将浓硫酸稀释后,用过量稀硫酸与样品反应,过滤、洗涤、干燥、称量、计算。
