(2010.浙江杭州38).在氢气还原氧化铜的实验中,向50克氧化铜粉末中通氢气,加热一段时间后,测得固体质量减少8g,求:
(1)已反应掉的氧化铜质量。(列式计算)
(2)若实验时用的氢气,是用右图标签所示的浓硫酸稀释成稀硫酸后和足量的锌粒反应制取的。取用浓 硫酸50毫升,小心加入到300毫升水中稀释,稀释后硫酸溶液的溶质质量分数为 。

(它解法正确同样给分)
(1)解:设参加反应的CuO的质量为X
H2+CuO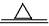 Cu十H2O 减少的固体质量
Cu十H2O 减少的固体质量
80 64 16
X 8克
80:16=X:8克
X= 40克
答:参加反应的CuO的质量为40克
(2)23%
本题考查的是根据化学反应方程式的计算,质量守恒定律及其应用,溶液的稀释。
(1)在加热条件下,氢气夺取氧化铜中的氧元素而变成水,氧化铜失去氧而变成铜;由于失去氧元素导致反应后残余固体质量减小;根据反应的化学方程式,利用反应前后固体物质的差量法,可由反应前后固体质量差计算参加反应的氧化铜的质量。
设参加反应的CuO的质量为X
H2+CuO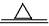 Cu十H2O 减少的固体质量
Cu十H2O 减少的固体质量
80 64 16
X 8克
80:16=X:8克
X= 40克
答:参加反应的CuO的质量为40克
(2)加水稀释,稀释前后溶质质量不变,即稀释后的溶质为50ml×1.84g/cm3×98℅,稀释后的溶液为50ml×1.84g/cm3+300ml×1.og/cm3,所以稀释后硫酸溶液的溶质质量分数为
50ml×1.84g/cm3×98℅÷(50ml×1.84g/cm3+300ml×1.0g/cm3)×100℅=23%
