(2011年浙江金华,37题)氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中的单质铜的含量进行测定。三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的同浓度的稀硫酸,充分反应后,对烧杯中剩余固体进行称量。实验数据记录如下:
| 组别 | 样品质量(克) | 加入稀硫酸质量(克) | 剩余固体质量(克) |
| 1 | 10 | 20 | 8.4 |
| 2 | 10 | 30 | 8 |
| 3 | 10 | 40 | 8 |
(1)分析表中数据可知,第2组实验中剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
(1)铜 (2)80%
(3)设20g稀硫酸中的溶质H2SO4的质量为x
CuO + H2SO4 ="===" CuSO4 + H2O
80 98
10g-8.4g x
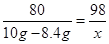 x=1.96g H2SO4%=1.96g/20g=9.8%
x=1.96g H2SO4%=1.96g/20g=9.8%
答:加入的稀硫酸溶质质量分数为9.8%。
(1)有题目给出的信息可知:第一次硫酸完全反应,第二、三次硫酸有剩余,氧化铜全部反应,剩余的固体只有铜.故答案为:铜
(2)有题目给出的信息可知铜的质量是8g,铜的质量分数=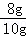 ×100%=80%,故答案为:80%
×100%=80%,故答案为:80%
(3)由表格信息可知:第一次硫酸完全反应,第二、三次硫酸有剩余,因此需要用第一次的数据.
设硫酸的质量为x
CuO+H2SO4=CuSO4+H2O
80 98
10g﹣8.4g x 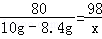 x=1.96g
x=1.96g
硫酸的质量分数=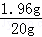 ×100%=9.8% 答:稀硫酸溶质质量分数是9.8%.
×100%=9.8% 答:稀硫酸溶质质量分数是9.8%.
故答案为:9.8%
本考点是有关化学方程式的计算题,属于表格型计算题.近几年的中考计算题,题型多样,主要有表格题、图象题、标签题、图象和表格相联系的综合题以及与文字叙述题等,从不同的方面考查了学生的识图能力、分析能力和计算能力.同学们要认真把握.
