(10广东省25)氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气和氢
氧化钠等物质,发生的化学反应如下:2NaCl + 2H2O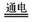 Cl2 ↑+ H2 ↑+ 2NaOH。现取100g
Cl2 ↑+ H2 ↑+ 2NaOH。现取100g
的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g。
请计算:
(1)生成氢气的质量是多少?剩余氯化钠的质量是多少?
(2)反应后溶液中NaOH的质量分数是多少?
⑴生产氢气的质量是0.2g,剩余氯化钠的质量是13.3g。
⑵反应后所得溶液中氢氧化钠的质量分数是8.63%。
本题考查的是根据化学反应方程式的计算,有关溶质质量分数的简单计算。
(1)由氯气的质量,根据化学方程式可以计算出剩余氯化钠和生成氢气、氢氧化钠的质量。
设生成氢气的质量为x,电解的氯化钠的质量为y,生成氢氧化钠的质量z
2NaCl + 2H2O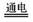 Cl2 ↑+ H2 ↑+ 2NaOH
Cl2 ↑+ H2 ↑+ 2NaOH
117 71 2 80
y 7.1g x z
71/2=7.1g/x 117/71=y/7.1g 71/80=7.1g/z
x=0.2g,y=11.7g,z=8g
所以剩余氯化钠的质量是100g×25%-11.7g=13.3g
(2)由氢氧化钠的质量和反应后溶液的质量可以计算出反应后溶液中氢氧化钠的质量分数,反应后溶液中氢氧化钠的质量分数为8g/(100g-7.1g-0.2g)×100%=8.63%
答:(1)生成氢气0.2g,剩余氯化钠13.3g,(2)反应后所得溶液中氢氧化钠的质量分数是8.63%。
