问题
计算题
(10汕头25)(9分)某探究小组同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定。
取50 g废水于烧杯中,加入足量BaCl2溶液,过滤、洗涤、干燥,得BaSO4固体11.65 g。
请回答:
(1)50 g废水中H2SO4的质量。
(2)若改用KOH溶液来测定50 g废水中H2SO4的含量,结果可能会 (填“偏
低”、“偏高”、“不变”),原因是  。
。
答案
解:(1)设50 g废水中H2SO4的质量为x
H2SO4+BaCl2===BaSO4↓+2HCl………………………………(1分)
98 233
x 11.65 g………………………………………(1分)
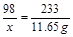 ………………………………………………………(1分)
………………………………………………………(1分)
x="4.9" g…………………………………………………………(1分)
答:50 g废水中H2SO4的质量为4.9 g。
(2) 偏高 (2分) 废水中含有HNO3 (2分),会消耗KOH (1分)
