问题
计算题
(10孝感12)、研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数。现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数。
(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O)
答案
解:依题意,生成CO2的质量为:73g+15g-85.8g=2.2g(1分)
设铜矿中碱式碳酸铜的质量为x,生成氯化铜质量为y(0.5分)
Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O
222 270 44
X y 2.2g
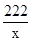 =
=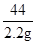 x=11.1g(1分)
x=11.1g(1分)
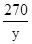 =
=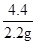 y=13.5g(1分)
y=13.5g(1分)
(1)铜矿中碱式碳酸铜的质量分数为: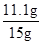 ×100%=74%(1分)
×100%=74%(1分)
(2)所得溶液中溶质的质量分数为: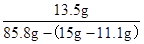 ×100%=16.5%(1分)
×100%=16.5%(1分)
答:铜矿中碱式碳酸铜的质量分数为74%,所得溶液中溶质的质量分数为16.5%(0.5分)
