问题
选择题
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
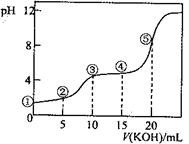
A.点①所示溶液中: c(H+)/c(OH—)=1012
B.点②所示溶液中: c(K+)+c(H+)=c(HC2O4—)+c(C2O42-)+c(OH—)
C.点③所示溶液中:c(K+)>c(HC2O4—)> c(H2C2O4)>c(C2O42-)
D.点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4—) +c(C2O42-)=0.10mol·L-1
答案
答案:D
c(H+)/c(OH—)=1012,则氢离子浓度是0.10mol/L,但草酸是弱酸,0.10mol/L的草酸溶液中氢离子浓度可能是0.10mol/L,A不正确。B不正确,不符合电荷守恒定律。点③所示溶液显酸性,说明HC2O4—的电离程度大于其水解程度,所以应该是c(K+)>c(HC2O4—)>c(C2O42-)> c(H2C2O4),C不正确。D正确,符合物料守恒,答案选D。
