NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度会由298K升至311K。已知这两个温度下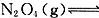 2NO2(g)的压力平衡常数KP分别为0.141和0.363。
2NO2(g)的压力平衡常数KP分别为0.141和0.363。
(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了多少倍。
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?为什么?
参考答案:
(1)①设混合气体未被压缩,在298K(V1,T1)达平衡,N2O4(g)的平衡分压为p1,NO2(g)的平衡分压为p2,则有
p1+p2=1atm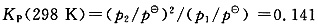
解得p1=0.688atm,p2=0.312atm。
②设针管压缩未发生平衡移动,已知pT1=1atm,T1=298K,T2=311K,V2/V1=1/2,根据理想气体状态方程pT1V1/T1=pT1V2/T2,解得pT2=2.087atm。则在311K时N2O4分压p1=0.688×2.087/1=1.436atm,NO2分压p2=0.312×2.087/1=0.651atm。
③压缩引起压力变化,平衡正向移动。设达平衡时N2O4分压减少xatm,NO2分压增加2xatm,则有
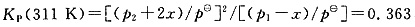 ,解得x=0.0317atm。则N2O4的平衡分压p1(311K)=1.436-0.0317=1.404(atm),NO2的平衡分压p2(311K)=0.651+0.0317×2=0.714(atm)。NO2压缩前后的浓度比为[p(NO2,311K)/T2]/[p(NO2,298K)/T1]=0.714/0.312=2.29,即NO2的浓度比压缩前增加了1.29倍。
,解得x=0.0317atm。则N2O4的平衡分压p1(311K)=1.436-0.0317=1.404(atm),NO2的平衡分压p2(311K)=0.651+0.0317×2=0.714(atm)。NO2压缩前后的浓度比为[p(NO2,311K)/T2]/[p(NO2,298K)/T1]=0.714/0.312=2.29,即NO2的浓度比压缩前增加了1.29倍。
(2)压缩后的混合气体在室温下放置,温度逐渐下降,平衡向放热方向移动,NO2聚合成N2O4,颜色由深变浅,直至体系温度降至室温,颜色不再变化。
