根据以下资料,回答111-115题。
某市2015年全年粮食总产量4.16万吨,同比下降2.3%;甘蔗产量0.57万吨,下降23.6%;油料产量0.12万吨,增长32.4%;蔬菜产量15.79万吨,下降3.4%;水果产量7.84万吨,增长7.4%。
全年水产品产量29.16万吨,同比增长3.6%,其中海洋捕捞1.09万吨,与上年持平;海水养殖6.07万吨,增长89.5%;淡水捕捞0.18万吨,增长1.1%;淡水养殖21.81万吨,下降7.9%。
按照2015年水产品产量从多到少,以下排序正确的是()
A.海洋捕捞、海水养殖、淡水捕捞,淡水养殖
B.淡水养殖、海水养殖、海洋捕捞、淡水捕捞
C.淡水捕捞、淡水养殖、海洋捕捞、海水养殖
D.淡水养殖、海洋捕捞、海水养殖、淡水捕捞
参考答案:B

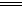 N2(g)+2H2O(l) △H="-a" kJ/mol
N2(g)+2H2O(l) △H="-a" kJ/mol Cu2O+H2↑,则阳极反应式为: 。
Cu2O+H2↑,则阳极反应式为: 。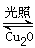 2H2(g)+O2(g) △H=+484 kJ·mol-1
2H2(g)+O2(g) △H=+484 kJ·mol-1