(5分)某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数。取20g石灰石样品(假设杂质既不溶于水,也不与其他物质反应),向其中加入100g溶质质量分数为10.95%的稀盐酸,恰好完全反应.请回答下列问题。
(1)欲配制100g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为________________
(2)写出反应的化学方程式 ________________
(3)列出求解该样品申参加反应的碳酸钙质量(x)的比例式 ________
(4) 该样品中碳酸钙的质量分数为________
(5)向反应后的固液混合物中加入l13.6g水.充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为________________
(1)30g
(2)CaCO+2HCl=CaCl2+H2O+CO2↑(3)100/73="X/10.95g" (4)7.5%
分析:(1)根据溶质质量一定,利用溶质质量分数公式进行计算即可.
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.据此写出化学方程式即可;
(3)根据已知条件盐酸溶液和溶质的质量分数然后根据碳酸钙与盐酸反应的化学方程式,即可得出求解该样品中参加反应的碳酸钙质量(x)的比例式;
(4)由(3)中计算出的该样品中参加反应的碳酸钙质量,根据质量分数公式( 样品中参加反应的碳酸钙质量/样品的质量×100%)计算即可;
(5)所得不饱和溶液的质量=反应前物质的总质量-杂质质量-二氧化碳的质量+加入水的质量,溶质质量就是(3)中计算出的溶质(CaCl2)的质量,然后根据溶质质量分数公式计算即可;
解答:解:(1)根据溶质质量稀释前后不变;设需要36.5%的浓盐酸质量为a
100g×10.95%=a×36.5%
a=30g
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)设该样品中参加反应的碳酸钙质量为x,生成氯化钙的质量为y,生成二氧化碳的质量为z,
CaCO3 +2HCl═CaCl2 +H2O+CO2↑
100 73 111 44
x 100g×10.95% y z
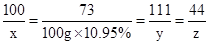
解之得:x=15g,y=16.65g,z=6.6g;
(4)该样品中碳酸钙的质量分数=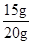 ×100%=75%;
×100%=75%;
(5)石灰石样品中杂质的质量为:20g-15g=5g,
所得不饱和溶液的质量为:100g+20g-5g-6.6g+113.6g=222g,
则所得不饱和溶液中溶质的质量分数为: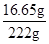 ×100%=7.5%;
×100%=7.5%;
故答案为:(1)30g
(2)CaCO3 +2HCl═CaCl2 +H2O+CO2↑
(3)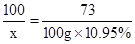
(4)75%
(5)7.5%
