节约资源和保护环境已经成为我们的基本国策。节能减排、环境保护和生态市建设是市政府近些年的工作重点。硫酸厂生产硫酸的流程是:把含硫矿物燃烧,生成二氧化硫,二氧化硫和氧气在高温和催化剂的作用生成三氧化硫,最后三氧化硫和水化合生成硫酸。写出三氧化硫和水化合生成硫酸的化学方程式
某纯碱样品中含有少量硫酸钠,现欲测定其碳酸钠的质量分数,利用含有少量硫酸的澄清废水进行如下实验:
《实验原理》Na2CO3+H2SO4 = Na2SO4 + H2O + CO2↑通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
《实验装置》
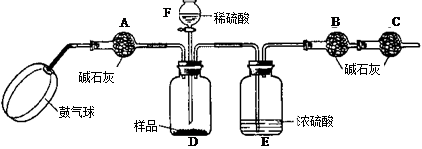
《实验步骤》
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
③按动鼓气球,持续鼓入空气约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是: ,以免使测定结果偏大。
(2) (能或不能)用稀盐酸代替稀硫酸,因为盐酸具有 性,会使测得碳酸钠的质量分数 (填偏大、偏小或不变,下同);若去除干燥管C,则测得碳酸钠的质量分数将会
(3)E装置的作用是
(4)本实验能否省略③、⑥两个步骤? (填能或不能),原因分别是 、
(5)若所取样品的质量为6g,分液漏斗F中盛放5%只含硫酸一种溶质的澄清废水,称得m1为51.20g,m2为53.40g,(计算结果保留两位小数)
求:(1)样品中碳酸钠的质量分数为多少?
(2)D装置中正好反应后,所得溶液的溶质质量分数是多少?
SO3+H2O=H2SO4 ⑴ 吸收空气中的二氧化碳和水,防止干扰实验。
(2)不能、挥发性、偏大、偏大(3)干燥生成的二氧化碳
(4)不可以,因为都要用空气赶二氧化碳,防止生成的二氧化碳溶解水中
(5)m二氧化碳=m2—m1=2.20g,m碳酸钠=5.30g 生成的 m碳酸钠=7.1g
m碳酸=4.9g m碳酸溶液="4.9g" ÷5%=98g
Na2CO3%=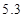 /6×100%=88.33% D装置中所得溶液的溶质质量分数是Na2SO4%=(6-5.3+7.1)g/(98+6-2.2)g=7.66%
/6×100%=88.33% D装置中所得溶液的溶质质量分数是Na2SO4%=(6-5.3+7.1)g/(98+6-2.2)g=7.66%
实验目的:测定某纯碱样品中其碳酸钠的质量分数,通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。干燥管都是吸收空气中的二氧化碳和水,防止干扰实验。)D装置中正好反应后,所得溶液的为硫酸钠溶液,但是硫酸钠样品中有一部分,还生成一部分。关键是溶液的总质量要注意求实数,二氧化碳逸出要减去其质量。
