问题
填空题
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA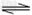 H++A-,则K=
H++A-,则K=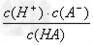 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
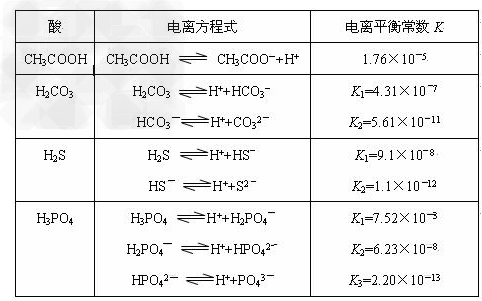
回答下列问题:
(1)当升高温度时,K值____(填“变大”“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___________ ____________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是_____,最弱的是_____。
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是______ ________,产生此规律的原因是_____________ _______________________。
(5)Na2CO3溶液呈_____(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是____________ ___________。
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
答案
(1)变大
(2)K值越大电离出的氢离子浓度越大,所以酸性越强。
(3)H3PO4 ;HPO42-
(4)K1:K2:K3 ≈1:10-5 :10-10;上一级电离产生的H+对下一级电离有抑制作用。
(5)碱性;“略”
(6)小于
