问题
计算题
某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取用20g此样品,分四次向其中加入稀盐酸与之充分反应。每次所用盐酸的体积与反应后剩余固体的质量见下表:
| 第次 | 加入稀盐酸的体积/mL | 剩余固体的质量/g |
| 1 | 40 | 16 |
| 2 | 40 | 12 |
| 3 | 40 | 8 |
| 4 | 40 | 8 |
(2)样品中氧化铜的质量分数
(3)用氢气充分还原5g此样品,可得到固体的质量。
答案
(1)第三、四次剩余固体均为8g,说明该剩余固体不能与盐酸反应,它一定是铜。因此20g样品中铜的质量为8g。
(2)CuO的质量分数: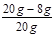 ×100%=60%
×100%=60%
(3)设用氢气还原5g样品生成铜的质量为x。
H2+CuO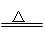 H2O+Cu
H2O+Cu
80 64
5g×60% x
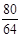 =
=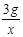 x=2.4g
x=2.4g
可得固体质量:2.4g+(5g-5g×60%)=4.4g
答:20g样品中铜的质量为8g,氧化铜的质量分数为60%,用氢气充分还原5g此样品只可得铜4.4g.
(1)根据铜和氧化铜的性质,加入稀盐酸时,铜不与稀盐酸反应,氧化铜与稀盐酸反应生了氯化铜和水,通过数据的对比分析,第三、四次剩余固体均为8g,说明该剩余固体不能与盐酸反应,它一定是铜,因此20g样品中铜的质量为8g;
(2)根据铜的质量可以求出氧化铜的质量,再根据混合物的质量就可以求出氧化铜的质量分数.
(3)根据氧化铜的质量分数,求出5g此样品中氧化铜、铜的质量,根据氧化铜的质量求出还原生成铜的质量,最后得到固体的质量
