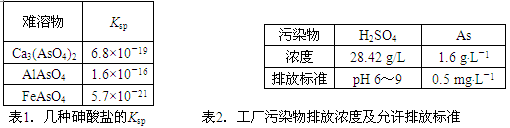
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= ________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ___mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 __;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 _____。
⑴0.29 ⑵c3 (Ca2+)·c2 (AsO43-) 5.7×10-17
⑶2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
⑷①CaSO4 ②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀
(1)根据28.42 g/L可知,硫酸的浓度是28.42÷98mol/L=0.29mol/L。
(2)根据溶度积常数的表达式可知,Ksp[Ca3(AsO4)2]=c3 (Ca2+)·c2 (AsO43-)。若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,则根据溶度积常数可知,c(AsO43-)分别是1.6×10-12mol/L、5.7×10-17mol/L。所以最大值不能超过5.7×10-17mol/L。
(3)二氧化锰的还原产物是Mn2+,所以方程式为2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O。
(4)①由于废水中含有硫酸,所以最先生成的沉淀是硫酸钙沉淀。
②由于H3AsO4是弱酸,所以当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀。
