请依据下列信息回答有关问题:
Cl2是一种黄绿色、具有刺激性气味、有毒的气体,其密度比空气的密度大。能与氢氧化钠溶液反应,生成氯化钠、次氯酸钠(NaClO)和水。Cl2可用于漂白纸张、布匹以及消毒饮用水等。在实验室里常用下述反应制取氯气:

⑴写出氯气与氢氧化钠溶液反应的化学方程式: ;生成物中氯元素的化合价分别为 。
⑵实验室选择气体发生装置应考虑的因素有哪些?
⑶如上图,在实验室里制取氯气应选择的发生装置是 (填字母);收集氯气选用D装置,请推测其中氢氧化钠溶液的作用是 。
⑷如上图,若选用B、E组合在实验室可制取 气体,反应方程式为 。
⑸12.5g大理石与稀盐酸完全反应后,可生成二氧化碳气体4.4g,请计算大理石中杂质的质量分数.
⑴Cl2 + 2NaOH == NaCl + NaClO + H2O (1分) ;-1、+1 (1分)
(2)反应物的状态和反应的条件。(1分)
(3)C (1分);吸收多余的氯气 (1分)
(4)氧气(1分); 2H2O2 ="==" 2H2O + O2↑(1分)(或氢气;Zn +H2SO4== ZnSO4 + H2↑)
(5)解:设CaCO3的质量为x。
CaCO3 + 2HCl ="=" CaCl2 + H2O + CO2↑ (1分)
100 44
x 4.4g
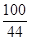 =
=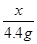
x = 10g (1分)
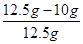 ×100%=20%
×100%=20%
答:大理石中杂质的质量分数为20%。 (1分)
(1)此题考查化学方程式的书写。此题要求会书写信息方程式,并能依次写出生成物中氯元素的化合价。
(2)此题考查实验室制取气体的思路。
(3)此题考查实验室制取气体的思路的理解和应用。因实验室制取氯气是用加热二氧化锰和浓盐酸的方法,即反应物为固体和液体,反应的条件为加热,所以应选C装置。由于氯气有毒,并能与氢氧化钠反应,故可用氢氧化钠溶液吸收多余的氯气。
(4)此题考查实验室制取氧气的反应原理和实验装置。
(5)先求出大理石中碳酸钙的质量,再求出杂质的质量即可求出杂质的质量分数。
