问题
计算题
(6分) 兴趣小组同学为测定汉白玉中碳酸钙的质量分数,称取11.1g研碎的汉白玉粉末进行四次高温加热、冷却、称量剩余固体的重复操作(已知:杂质中不含钙元素,且不参加反应)。记录数据如下:
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | 8.5 | 6.9 | 6.7 | 6.7 |
(1)完全反应后产生的二氧化碳质量为 g;
(2)汉白玉中碳酸钙的质量分数;(写出计算过程,结果保留到0.1%)
(3)第二次称得固体中钙元素的质量分数为 (结果保留到0.1%)。
答案
4.4g; 90.1% 1.2%
(1)完全反应后生成二氧化碳的质量为:11.1g-6.7g=4.4g.
(2)设5.55g汉白玉粉末中含碳酸钙质量为x
CaCO3=加热=CaO+CO2↑
100 44
x 4.4g
解之得:x=10g
汉白玉中碳酸钙的质量分数:10g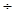 11.1g×100%≈90.1%;
11.1g×100%≈90.1%;
答:汉白玉中碳酸钙的质量分数为90.1%.
(3)第二次称得固体中碳酸钙的质量为:6.9g-6.7g=0.2g
第二次称得固体中钙元素的质量分数为:0.2×40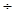 100
100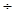 6.9g×100%≈1.2%
6.9g×100%≈1.2%
故答案为:1.2%;
