某课外活动小组用注射器作反应器,对铜与稀硝酸反应的实验进行了创新设计。根据实验操作回答有关问题(假定实验在标准状况下进行,空气中N2和O2的体积之比为4:1):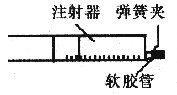
(1)图示是一支规格为50mL的注射器(活塞与针筒间的润滑性良好),在注射器中加入48mg铜片,然后拔出针头,在安针头处套上软胶管。
(2)先抽取少量6mol/L的稀硝酸,并立即排至废液缸中,目的是______。
(3)再抽取10mL 6mol/L的稀硝酸,把弹簧夹夹在软胶管上,反应开始时缓慢,然后逐渐加快。请问在注射器中可观察到哪些现象请依次写出。______
(4)反应完毕后,打开止水夹,立即将活塞拉至36.2mL处,夹好弹簧夹,观察到______,轻摇注射器几下,静置,又观察到______、______;重复以上操作几次,至针筒内最后无NO为止。针筒内溶液中
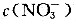 为______,c(H+)为______。共抽入空气体积至少为______。
为______,c(H+)为______。共抽入空气体积至少为______。
参考答案:
(2)排出注射器内残留的少量空气
(3)①铜片表面有气泡逸出,针筒内聚集无色气体;②溶液由无色变为蓝色;③铜片全部溶解;④活塞自动移到刻度约21.2mL处
(4)NO被吸入的空气氧化为红棕色的NO2 与水反应又变成无色 活塞由36.2mL处慢慢移动到约29.2mL处 6mol/L 5.85 mol/L 42mL
解析:
本题是对铜与稀硝酸反应实验的创新设计,也是对思维能力的创新考查。在回答实验现象时要叙述完整,注意思维的有序性;在进行计算时要抓住物质的量的关系,注意思维的深刻性。
(2)其目的是为了排出注射器内残留的少量空气。
(3)首先分析反应的化学方程式,再联想实验情景进行推理回答:①铜片表面有气泡逸出,针筒内聚集无色气体;②溶液由无色变为蓝色;③由铜与稀硝酸反应的物质的量判断硝酸过量,可知铜片全部溶解;④通过计算48 mg铜片完全反应产生难溶于水的NO 11.2mL知,活塞自动移到刻度约21.2mL处(10mL+11.2mL=21.2mL)。
(4)NO被吸入的空气氧化为红棕色的NO2,红棕色的NO2与水反应又变为无色。已知:[*],气体体积共减少7mL(15mL空气中约有3mL O2),活塞由36.2mL处慢慢移到约29.2mL处;从结果看[*]浓度守恒,仍为6mol·L-1;依总反应:2Cu+[*]计算得H+的浓度为(10×10-3L×6mol·L-1=0.048g/64g·mol-1×[*]×4)÷(10×10-3L)=5.85mol·L-1;抽入空气的体积为0.048g/64g·mol-1×[*]×5×22400mL·mol-1=42mL。
