下列物质中按混合物、氧化物、单质的顺序排列的是 【 】
A.冰水混合物水银食醋
B.清新的空气氖气水
C.可口可乐饮料过氧化氢红磷
D.酱油氯酸钾液氧
答案:C
本题考查单质和化合物的判别,从组成上识别氧化物,纯净物和混合物的判别。利用单质、氧化物、混合物的概念来判断。单质是由一种元素组成的纯净物,氧化物是由两种元素组成,其中一种是氧元素的化合物,混合物是由多种物质组成。
A、冰水混合物是氧化物,水银是单质,食醋是混合物,故A错;
B、清新的空气是混合物,氖气是单质,水是氧化物,故B错;
C、可口可乐饮料是混合物,过氧化氢是氧化物,红磷是单质,故C正确;
D、酱油是混合物,氯酸钾是化合物,液氧是单质,故D错。故选C

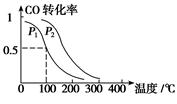
 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。