问题
计算题
(6分)某校化学小组的同学想探究生铁中碳的含量,他们取组成完全相同的三份生铁(假设生铁中只含铁和碳),分别加入50g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后得到下表的实验数据:请计算:(计算结果精确到0. 1%):
| 实验次数 | 实验I | 实验Ⅱ | 实验Ⅲ |
| 生铁的质量 | 2.9g | 5.8g | 7.2g |
| 氢气的质量 | 0.1g | 0.2g | 0.2g |
(1)该生铁中碳的质量分数为 。
(2)所用稀硫酸的溶质质量分数是多少?
答案
(共6分)
(1)3.4% (2分)
(2)由表中数据分析可知,实验Ⅱ中50g稀硫酸已完全反应。
解:设50g稀硫酸中含H2SO4的质量为x
Fe+H2SO4===FeSO4 + H2↑ (1分)
98 2
X 0.2g
 解得: x ="9." 8g (2分)
解得: x ="9." 8g (2分)
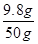 ×100% = 19.6% (1分)
×100% = 19.6% (1分)
答:(略)
由三次实验数据可知,实验Ⅱ二者恰好完全反应,所以要根据此组实验来求,所以设50g稀硫酸中含H2SO4的质量为x,生铁中铁的质量为y,
Fe+H2SO4===FeSO4 + H2↑
56 98 2
y X 0.2g
 56/2=y/0.2g 解得: x ="9." 8g y=5.6
56/2=y/0.2g 解得: x ="9." 8g y=5.6
5.8g生铁中碳的质量=5.8-5.6=0.2g,其质量分数=0.2/5.8=3.4%
稀硫酸的溶质质量分数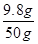 ×100% = 19.6% (1分)
×100% = 19.6% (1分)
