问题
计算题
(10分).取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,将加热后剩固体冷却到室温,把40g水分4次加入剩余固体中充分溶解。加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
| 编号 | l | 2 | 3 | 4 |
| 加水的质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 7.25 | 4.05 | 3 | m |
(2)所制得氧气的质量;
(3)剩余固体加入40g水后,形成溶液溶质的质量分数(计算结果精确到0.1%)。
答案
(1)3; (2)4.8g; (3)15.7%
由图表可知,加入10g水最多溶解KCl的质量和第三、第四次加水后溶解KCl的质量,比较可知剩余的固体全部是不溶于水的MnO2,据此答题;
根据化学方程式,可以得出各物质之间的质量比,写出比例式,就可计算得出所制得氧气的质量和氯化钾的质量
(2)(3)KClO3的质量="15.25g-3g=12.25g" (1分)
设反应产生的氧气质量为x,产生的氯化钾质量为y
2KClO3 2KCl+3O2↑ (1分)
2KCl+3O2↑ (1分)
245 149 96
12.25g y x
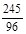 =
=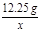 x=4.8g (2分)
x=4.8g (2分)
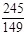 =
=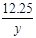 y=7.45g (2分)
y=7.45g (2分)
(2)所得的氧气质量为4.8g
(3)形成氯化钾溶液的质量分数=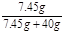 ×100%=15.7% (2分)
×100%=15.7% (2分)

 W
W