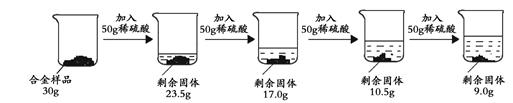
某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,让后将200g溶质质量分数为19.6%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据如下:
请计算:
(1)该合金中铜的质量分数为 。
(2)该合金除铜外,另一种金属是 。(写出过程)
(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数。
(1)30% ; (2)65,该金属应该是锌; (3)硫酸锌质量48.3g,氢气质量0.6g
本题考查了金属和稀酸反应的化学方程式的计算。
(1)由第一次加入50g的稀硫酸合金的质量减少了6.5g,第二次再加50g稀盐酸时,合金的质量又减少6.5g,所以得出每加入50g的稀硫酸合金的质量就会减少6.5g,说明50g的稀硫酸和6.5g的合金确好完全反应,最后加入50g稀硫酸时减少的质量只有1.5g,所以剩余物质的质量即为铜的质量
(2)由50g的稀硫酸和6.5g的合金确好完全反应,求出金属的相对原子质量
解:设另一种金属为M,相对原子质量为X。
M + H2SO4=MSO4+H2↑
X 98
6.5g 50g×19.6%
X=65
所以该金属是锌。············································1分
(3)第三次后剩余固体的质量为10.5g,因此反应掉的物质的质量即为30g-10.5g=19.5g,由19.5g锌的质量求出反应生成的硫酸锌的质量,反应后溶液的质量=锌的质量+稀硫酸的质量-氢气的质量
解:设第三次反应后生成硫酸锌的质量为Y,氢气质量为Z。
Zn + H2SO4=ZnSO4+H2↑
98 161 2
50g×3×19.6% Y Z
Y=48.3g Z=0.6g
×100%≈28.6% ·······························1分
