(10分)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用.下列图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化及相关实验操作.请从图象中获取信息,回答下列问题
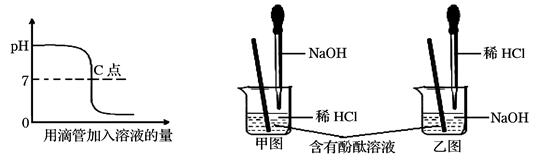
(1)进行该反应的实验操作是按照以上 (填甲或乙)图所示进行,烧杯中溶液的颜色变化是 ;曲线上C点表示 ;
(2)如果有36.5g的稀盐酸与40g 10%氢氧化钠溶液恰好完全反应,求:稀盐酸的溶质质量分数和反应后所得溶液中溶质的质量。(写出计算过程)
(10分)乙(1分);乙由红色变为无色(1分);由红色变为无色盐酸和氢氧化钠恰好完全中和(1分)
(2)稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量为5.85g.
氢氧化钠为碱,显碱性,其PH大于7,能使酚酞变红,盐酸为酸,显酸性,其PH小于7,不能使酚酞变色,二者恰好完全反应时生成氯化钠和水,要求反应后溶液的溶质质量,需根据反应的化学方程式求出氯化钠的质量.
(2)设参加反应的HCl质量为X,反应生成的NaCl的质量为Y,则有
NaOH + HCl = NaCl + H2O (1分)
40 36.5 58.5
40g×10% X Y (1分)
 ×10%=
×10%=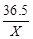 (1分)
(1分)
X=3.65g (1分)
稀盐酸的溶质质量分数为: ×100%="10%" (1分)
×100%="10%" (1分)
 ×10%=
×10%=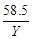 (1分)
(1分)
Y=5.85g (1分)
答:稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量为5.85g.
