(6分)某同学设计了一套如下图所示的装置,并用该装置测定粗锌样品的含锌量。
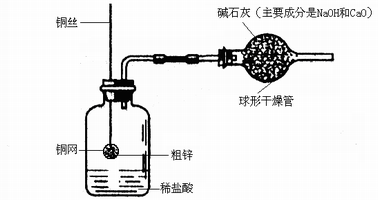
(1)称量10.0g粗锌放在铜网中,按图将仪器组装好以后,称得仪器和药品总质量为120.0g。
(2)将铜网插入足量稀盐酸中,充分反应,可以观察到的实验现象为 ,
反应的化学方程式为 。
(3)反应完全后,称得装置总质量为119.8g。则粗锌的纯度为 。
(4)该实验中碱石灰的作用是干燥剂,同时防止稀盐酸挥发出的氯化氢气体逸散到空气中。
若不用碱石灰,则所测定的粗锌纯度 (填“偏大”、“偏小”或“无影响”;
不考虑空气中CO2和H2O对实验的影响)。
(5)若将粗锌换成石灰石,原实验方案 (填“能”或“不能”)用于石灰石
样品纯度的测定,理由是 。
(2)产生气泡 Zn+2HCl ZnCl 2+H2↑
ZnCl 2+H2↑
(3)65% (4)偏大
(5)不能 碱石灰能吸收二氧化碳和水蒸气等气体,导致不能测出CO2的质量
(2)锌与盐酸反应生成氯化锌和氢气,产生气泡
(3)氢气的质量=120g-119.8g=0.2g,根据化学方程式列比例式求得锌的质量,
(4)稀盐酸挥发出的氯化氢气体逸散到空气中,使装置总质量减小,氢气的质量偏大求得锌的质量也偏大,所测定的粗锌纯度偏大
(5)碱石灰能吸收二氧化碳和水蒸气等气体,导致不能测出CO2的质量
