现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示。
| 硫酸(500mL) 品名:硫酸 化学式: 密度: |
(1) 的相对分子质量是 。
的相对分子质量是 。
(2) 分子中,H、S、O的原子个数比为 。
分子中,H、S、O的原子个数比为 。
(3)该瓶浓硫酸的质量为 g。
(4)用100g98%的该浓硫酸稀释成19.6%的稀硫酸,需要水多少g?
(5)某同学用锌粒与19.6%的稀硫酸反应制取氢气,反应所用的稀硫酸和生成氢气的关系如右图。
计算:
①至少需要多少g的锌粒?
②完全反应后所得溶液的溶质质量分数为多少?
(保留一位小数点)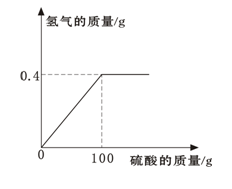
(1)98 (1分) (2)2:1:4 (1分) (3)920(1分) (4)400g (5) 32.2g;28.6%
(1)根据相对分子质量为各元素相对原子质量的和来计算硫酸的相对分子质量即可;利用各元素质量比为各元素相对原子质量和的比来计算硫酸中H、S、O元素的质量比即可
(2)由反应的曲线图可得知,锌稀硫酸完全反应生产的氢气;利用锌和硫酸反应的化学方程式,求出锌的质量.ZnSO4质量。
(3)硫酸的质量等于硫酸的体积与密度乘积.
(4)利用稀释前后溶质的质量不变列出等式进行解决.
解:设需要水质量为x
100g ×98%=(100+x) ×19.6%
x=400g (1分)
(5)①设需要锌的质量为x,生成ZnSO4质量为y
H2SO4 + Zn =ZnSO4 + H2↑ (1分)
65 161 2
x y 0.4
=, x=13g (1分)
=, y=32.2g (1分)
反应后所得溶液的溶质质量分数为:
ZnSO4%= ×100%=28.6%(1分)
(用H2SO4质量来计算同样给分)

 质量分数:98%
质量分数:98%