某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合液(不考虑其他杂质)进行如下实验:取一定量该混合液于烧杯中,滴加40g溶质质量分数为10.6%的碳酸钠溶液后,称得烧杯内溶液总质量为68.5g。滴入碳酸钠溶液的质量与生成沉淀质量关系如图所示。
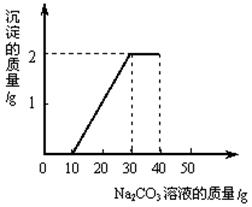
(1)一开始没有沉淀生成的原因是碳酸钠先与盐酸反应,则与盐酸反应的碳酸钠溶液的质量为 g;
(2)求所取溶合溶液中氯化钙的质量;
(3)求恰好完全反应时溶液中溶质的质量分数。
(1)10g
(2)设氯化钙的质量为X
Na2CO3+ CaCl2="Ca" CO3↓+ 2NaCl
111 100
X 2g
111/100=X/2g,解得X=2.22g.
(3)无论碳酸钠和盐酸反应还是和氯化钙反应都是生成的氯化钠,所以根据共反应掉40克碳酸钠溶液直接求生成氯化钠的质量,设氯化钠的质量为Y,
Na2CO3-------2NaCl
106 117
40g*10.6% Y
106/117=40g*10.6%/Y
解得Y=4.68克,最终溶液质量为68.5g-2=66.5g
则恰好完全反应时溶液中溶质的质量分数4.68/66.5*100%=7%
写出碳酸钠与氯化钙反应的化学方程式1分(少沉淀符号也给分),格式规范(含设、答,不多不少g,比例式)1分
(1)由图像可以看出盐酸反应的碳酸钠溶液的质量为10g
(2)(3)根据生成沉淀2克,即可求出氯化钙的质量,溶液中溶质的质量分数。具体步骤见答案。
