(16分)硫酸盐有着广泛的应用。
(1)以下是CuSO4·5H2O的实验室制备流程图。
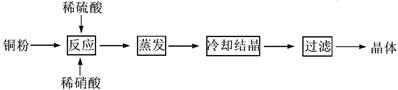
根据题意完成下列填空:
① 理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,发生反应的离子方程式为 。
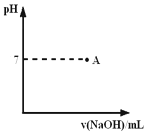
② 实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是 。请在下图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
③用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢 复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
(2)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为: mol.
(用含m、n的代数式表示)。
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是
①醋酸铅可溶于水 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
⑤因醋酸是弱酸,故反应可进行

 (18分)
(18分)
(1)①3:2 (2分)3Cu +8H+ +2NO3-= 3Cu2+ + 2NO↑+4H2O(2分)
② 溶液由无色变成红色(或浅红色),且半分钟内不褪色(2分)
 (2分)
(2分)
③0.6mol(2分)
(2)①BaCl2或Ba(OH)2 (2分) ②过滤、洗涤、干燥(或烘干)(2分)
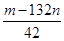 mol(2分)
mol(2分)
(3) ①②③ (少选得1分,多选、错选无分) (2分)
(1)①在酸性条件下,硝酸盐具有氧化性,能氧化单质铜,反应的离子方程式是3Cu +8H+ +2NO3-= 3Cu2+ + 2NO↑+4H2O。根据方程式可知,如果硝酸的物质的量是2mol,则根据氢原子守恒可知,硫酸的物质的量就是(8mol-2mol)÷2=3mol,所以硫酸和硝酸的物质的量之比是3︰2。
②由于酸不能使酚酞变色,而碱可以使酚酞显红色,所以终点时的现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色。由于随着氢氧化钠溶液的滴加,溶液的pH会逐渐增大,邻近终点时pH会方式突变,所以正确的图像是:
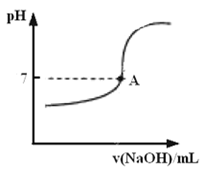 。
。
③根据离子的放电顺序可知,惰性电极电解一定浓度的硫酸铜溶液时,阳极是溶液中的OH-放电,而阴极首先是Cu2+放电,然后是溶液中的氢离子放电。由于向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH,而Cu2 (OH)2CO3可以写成2CuO·CO2·H2O,反应中转移电子的物质的量是0.1mol×2×2+0.1mol×2×1=0.6mol。(2)①产生的白色沉淀应该是硫酸钡,所以加入的试剂是BaCl2或Ba(OH)2。
②从溶液中分离出白色沉淀应该是过滤。过滤出的沉淀必须通过洗涤和干燥,即正确的操作分别是过滤、洗涤、干燥(或烘干)。
③设K2SO4、(NH4)2SO4的物质的量分别是x和y,则x+y=n,144x+132y=m,解得x=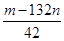 mol。
mol。
(3)离子反应发生的条件有气体生成或有沉淀生成或者有难电离的物质生成,由于硫酸铅不溶于水,所以根据有PbSO4难溶于水却可溶于醋酸可知选项①②③都是正确的,而与醋酸是弱酸无关系,答案选①②③。
