问题
计算题
(5分)已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20g Na2CO3和NaCl 组成的固体混合物。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入
稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
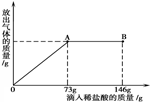
(1)当滴加稀盐酸至图中A点时,烧杯中溶液pH 7(填>、=、<);至图中B点时,溶液中的溶质为 (填化学式)
(2)求原混合物中氯化钠的质量分数。
答案
(1)= NaCl HCl 2分 (2)47﹪
(1)不在放出气体了,说明碳酸钠反应没了,A点时是恰好完全反应时,生成的是氯化钠,所以pH=7,B点盐酸过量,所以溶液中溶质为NaCl HCl。
(2)可以根据A点恰好完全反应时,用掉盐酸73克,根据盐酸的质量就可以求出碳酸钠的质量,然后就可以求出氯化钠了
(2)设原混合物中碳酸钠的质量为x,
Na2CO3+ 2HCl=" 2" NaCl+ H2O+ CO2↑
106 73
X 73g*10%
106/73="x/" 73g*10%
解得x=10.6g,
所以原混合物中氯化钠的质量为20g-10.6g=9.4g
所以原混合物中氯化钠的质量分数为:9.4/20*100%=47﹪
( 化学方程式1分 求出碳酸钠的质量1分 求出氯化钠的质量分数1分)
