(9分)实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液。需要氢氧化钠固体的质量为 g。
(2)配制过程中除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 ,
其作用是 。
(3)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示:
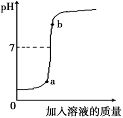
①要得到此变化曲线,所进行的操作是 (填字母)。
A.将盐酸溶液滴加到氢氧化钠溶液中
B.将氢氧化钠溶液滴加到盐酸溶液中
②b点对应的溶液中的溶质为 (写化学式)。
(4)恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数(请写出计算过程)。
(1)8 (2)玻璃棒 搅拌,加速溶解
(3)①B ②NaCl、NaOH (4)2.92%
(1)根据溶质的质量分数的计算公式可求出氢氧化钠的质量;
(2)配制溶液时要用玻璃棒不断搅拌,加速固体溶质的溶解;
(3)根据pH的变化情况判断酸碱的相互滴加情况和混合液中的溶质成分;
(4)当pH=7时,两者恰好完全反应,利用图象和此时参加反应的氢氧化钠溶液的质量;然后利用化学方程式的计算可求出参加反应的盐酸中氯化氢的质量,从而计算出其溶质的质量分数
(4)设盐酸溶液中溶质的质量为x (设、答共1分)
NaOH + HCl = NaCl + H2O (1分)
40 36.5
20g×4% x
x=0.73g (1分)
0.73g/25g×100%=2.92% (1分)
