下图A、B、C是实验室常用的气体发生装置,装置A中①为分液漏斗,通过分液漏斗活塞的“开”、“关”,可以向锥形瓶中滴加液体。请回答下列问题:
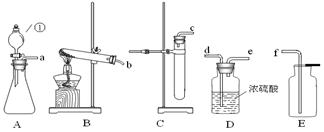
(1)在装置B中,若用高锰酸钾制氧气,管口还应放 ,其作用是 ;若用氯酸钾和二氧化锰制氧气,请写出该反应的化学方程式: 。
(2)已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气,该反应的化学方程式为: 。
(3)在实验室若用A作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是(填写管口字母) ;若只改变A装置中的药品,仍采用已连接的整套装置,还可以用来制取 气体。
(4)D中浓硫酸的作用是 .。
(5)若取16g高锰酸钾放入B的试管中,加热一段时间后,固体质量减少了1.6g,请计算试管中剩余高锰酸钾的质量为多少克?
(1)一团棉花 防止高锰酸钾进入导气管;2KClO3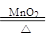 2KCl+3O2↑
2KCl+3O2↑
(2) 2Na2O2 + 2H2O =" 4" NaOH + O2↑
(3)adef 二氧化碳或硫化氢
(4)干燥气体
(5) 0.2g
(1)高锰酸钾是粉末状固体,生成的氧气气流很容易将其吹入到导气管中,阻碍氧气导出,管口放一团棉花可以防止高锰酸钾进入导气管。氯酸钾和二氧化锰制氧气,二氧化锰起催化作用,故其化学方程式为2KClO3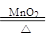 2KCl+3O2↑。
2KCl+3O2↑。
(2)由题干所给信息可知,过氧化钠常温下与水反应生成氢氧化钠和氧气,故该反应方程式为2Na2O2 + 2H2O =" 4" NaOH + O2↑。
(3)制取的氧气可能混有水蒸气,因此得到干燥的氧气就需要干燥和向上排空气法收集,装置连接顺序为adef;实验室用石灰石固体和盐酸制二氧化碳气体,所以二氧化碳气体也可能混有水蒸气,得到干燥的二氧化碳气体也需要干燥和向上排空气法收集制取二氧化碳气体;或实验室用硫化亚铁固体和盐酸制硫化氢气体,所以硫化氢也可能混有水蒸气,得到干燥的硫化氢气体也需要干燥和向上排空气法收集.
(4)浓硫酸具有吸水性,可以用于干燥气体。
(5)解:设剩余高锰酸钾的质量为x。
2KMnO4 △ K2MnO4+ MnO2+O2↑ (1分)
316 32
16g-x 1.6g
316:32= (16g-x ):1.8g (1分)
x=0.2g
答:剩余高锰酸钾的质量为0.2g。 (1分)
