(3分)碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如下图所示。另取相同质量的该混合物溶于水得到106.6 g溶液,向该溶液中加入100 g 7.3% 的稀盐酸,恰好完全反应。(已知:2NaHCO3 Na2CO3+CO2↑+H2O,碳酸钠受热不易分解。)
计算:(1)混合物与盐酸反应生成二氧化碳的质量。(2)所得溶液中溶质的质量分数。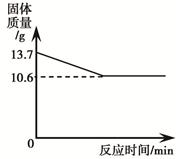
(1)6.6g; (2)5.85%
由图可知固体减少的质量是生产二氧化碳和水的质量,然后根据质量守恒定律进行解答。
解:设混合物中碳酸氢钠的质量为x;碳酸氢钠与盐酸反应生成二氧化碳的质量为y、碳酸钠与盐酸反应生成二氧化碳的质量为z
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2×84 (44 + 18)
x 3.1 g
.............................1分 |
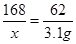 x = 8.4g
x = 8.4gNaHCO3 +HCl =" NaCl" + CO2↑+H2O
84 44
8.4 g y
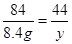
y = 4.4g
混合物中碳酸钠的质量为:13.7g -8.4g = 5.3g
Na2CO3 +2HCl =" 2NaCl" + CO2↑+H2O
106 44
5.3 g z
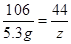
...............1分 |
反应后溶液的质量:106.6 g+100 g-6.6 g =" 200" g,
根据氯元素守恒,设反应生成氯化钠的质量为m
HCl ~ NaCl
36.5 58.5
100 g× 7.3% m
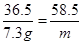
...............1分 |
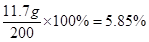
答:混合物与盐酸反应生成二氧化碳的质量为6.6g;与盐酸反应后溶液中氯化钠的质量分数是5.85%。
