(7分)2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
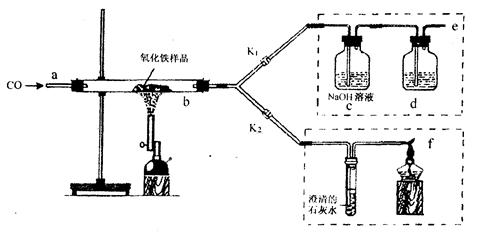
①这是关于气体的实验,实验前必须对装置进行装置的气密性检查
②CO还原Fe2O3的化学方程式为 ;
③在f处点燃气体的目的是 。
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用。
①d瓶中应装 (填序号)。
A.澄清石灰水
B.水
C.石蕊溶液
D.浓硫酸②该实验这样改进的主要优点是 。
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数。小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
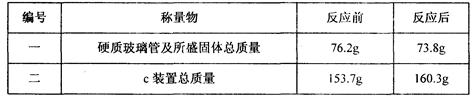
①由上表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是 的质量。
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程)。
(1)②Fe2O3+3CO 2Fe+3CO2(1分)
2Fe+3CO2(1分)
③除去未反应的CO,防止空气污染(1分)
(2)①D (1分)②减少碳的排放,提高原料利用率(1分)
(3)①氧元素 ②80%
(1)②一氧化碳和氧化碳生成铁和二氧化碳③一氧化碳有毒,要及时处理防止污染大气;
(2)应除去气体中的水分,循环使用减少碳的排放,提高原料利用率
(3) ①根据氧化铁与一氧化碳的反应原理可知,反应后硬质玻璃管及所盛固体总质量减少的是氧化铁中氧元素的质量,
②根据二氧化碳与氢氧化钠反应生成碳酸钠和水,由c装置总质量变化的数据可知增加的质量是二氧化碳的质量,利用化学方程式可求出氧化铁的质量,进而求出样品中氧化铁的质量分数
②解:设样品中氧化铁的质量为x
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 132
x (160.3-153.7)g
160:132=x:6.6g x="8g" (1分)
8g/10g×100%="80%" (1分)
答:样品中氧化铁的质量分数为80%
