(6分)有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复)。
| 阳离子 | Na+、K+、Ba2+、NH4+ |
| 阴离子 | SO42-、Cl-、OH-、CH3COO- |
①A、C溶液的pH均大于7,B溶液的pH小于7;D溶液焰色反应显黄色。
②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后生成有刺激性气味的气体。
(1)B中阳离子是(填化学式) 。
(2)写出C溶液与D溶液反应的离子方程式: 。
⑶25℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是 (填A或C的化学式)。
⑷25℃时,用惰性电极电解 D 的水溶液,一段时间后溶液的pH_____7(填“>”、“<”或“=”)。
⑸将等体积等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
⑹25℃时,在一定体积0.2 mol · L—1的C溶液中,加入一定体积的0.1 mol · L-1的盐酸时,混合溶液的pH=13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _
(6分)⑴ NH4+(1分) ⑵ Ba2+ + SO42—=BaSO4↓(1分) ⑶ Ba(OH) 2(1分) ⑷ =(1分) ⑸ c (OH—) >c (Ba2+) = c (Cl—) >c (NH4+) >c (H+) (1分。只要有错误即0分。) ⑹ 2∶3 (1分)
题目分析:D溶液焰色反应显黄色,所以D中含有钠离子。B溶液的pH小于7,说明B中含有NH4+,水解溶液显酸性。A、C溶液的pH均大于7,说明A和C是碱或盐水解溶液显碱性。B溶液与C溶液混合后生成有刺激性气味的气体,因此C是强碱,含有OH—。C溶液与D溶液混合后生成白色沉淀,所以C是氢氧化钡,D是硫酸钠,二者混合生成硫酸钡白色沉淀。由于醋酸铵溶液显中性,所以根据溶液的酸碱性可知,A是醋酸钾,B是氯化铵。
(1)、(2)见答案
(3)氢氧化钡是强碱抑制水的电离,醋酸钾水解促进水的电离,所以溶液中水的电离程度小的是氢氧化钡。
(4)惰性电极电解硫酸钠水溶液,相当于电解水,溶剂减少,硫酸钠浓度增大,但溶液的pH不变,仍然是7。
(5)将等体积等物质的量浓度的氯化铵溶液和氢氧化钡溶液混合,生成物是氯化钡和氨水,其中氢氧化钡是过量的,由于氯化铵水解,所以离子浓度大小顺序是 c (OH—) >c (Ba2+) = c (Cl—) >c (NH4+) >c (H+)。
(6)根据题意可知氢氧化钡是过量的,所以有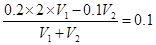 ,解得V1︰V2=2︰3。
,解得V1︰V2=2︰3。
点评:该题等关键是关键离子的性质、溶液的pH等判断出含有的离子。也就是说进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
