已知硫酸在水中的电离方程式是:H2SO4═ H+ + HSO4-, HSO4-  H++SO42-,回答下列问题:
H++SO42-,回答下列问题:
(1)Na2SO4溶液显_______(填“酸性”,“中性”或“碱性”)。理由是__________(用离子方程式表示) 。
(2)在0.1 mol/L的Na2SO4溶液中,下列微粒浓度关系正确的有________。
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1 mol/L
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(3)如果25 ℃时,0.1 mol/L的NaHSO4溶液中c(SO42-)=0.029 mol/L,则0.1 mol/LH2SO4溶液中c(SO42-)_____0.029 mol/L(填“<”,“>”或“=”),理由是_________________。
(4)0.1 mol/LNaHSO4溶液中各种离子浓度由大到小的顺序是:________________。
(5)如果25 ℃时,0.10 mol/LH2SO4溶液的pH=-lg 0.11, 则25 ℃时,0.10 mol/L的H2SO4溶液中c(SO42-)=____________。
(1)碱性;SO42-+H2O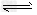 HSO4-+OH-
HSO4-+OH-
(2)BCD
(3)<;H2SO4第一步电离产生的H+,抑制了HSO4-
(4)c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-)
(5)0.010 mol·L-1
