(6分)早在春秋战国时期,我国就开始生产和使用铁器。铁矿石冶炼成铁是一个复杂的过程。(1)工业上把铁矿石和焦炭、石灰石一起加入 (写设备名称),在高温下,利用焦炭与氧气反应生成的 把铁从铁矿石里还原出来。
(2)若铁矿石选用赤铁矿(主要成分是氧化铁),表示炼铁原理的化学方程式为 。
(3)要炼出含铁96%的生铁4000t,至少需要含氧化铁80%的赤铁矿石的质量是多少?
(请写出详细的计算过程,结果保留一位小数)
(1)高炉 一氧化碳(写“CO”亦可) (2)3CO+Fe2O3高温2Fe+3CO2(此空只要化学式错就不给分;配平、反应条件、气体符号、沉淀符号等不符合要求,总扣0.5分) (3)6857.1t
(1)依据高炉炼铁的原理分析并解决.
(2)利用一氧化碳与氧化铁反应生成铁与二氧化碳书写即可.
(3)根据工业冶铁的反应原理:一氧化碳与氧化铁反应生成铁和二氧化碳的化学方程式,由反应中铁与氧化铁的质量关系,利用生产的生铁中铁的质量计算参加反应氧化铁的质量,从而求得含氧化铁80%的赤铁矿的质量.
(3)解:设至少需要含氧化铁80%的赤铁矿石的质量是x 。
3CO + Fe2O3 高温 2Fe + 3CO2
160 112
80% x 4000t×96%
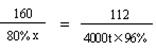
x = 6857.1t
答:至少需要含氧化铁80%的赤铁矿石6857.1t 。
