问题
计算题
为测定某石灰石样品中碳酸钙的含量,取样品10g于烧杯中,再向其中加入稀盐酸50g,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为56.7g。
(CaCO3+2HCl=CaCl2+CO2↑+H2O)
(1)生成CO2的质量为_______ g。
(2)求石灰石样品中碳酸钙的质量分数。
答案
(1)3.3 (2分)
(2)假设、答、单位 ------(1分)
解:设石灰石样品中含碳酸钙的质量为X。
CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O
100 44
X 3.3g ---------(1分)
100/44=X/3.3g -----(1分)
解得: X=7.5g -----(1分)
样品中碳酸钙的质量分数为:
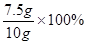 =75% -------(2分)
=75% -------(2分)
答:石灰石样品中含碳酸钙的质量分数为75%。
(1)根据质量守恒定律可知质量的减少量就是生成二氧化碳的质量;(2)根据二氧化碳的质量算出碳酸钙的质量,再除以样品质量即可.
