下列叙述正确的是( )。
A.为计算反应
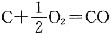 的反应热,可设计热化学循环:
的反应热,可设计热化学循环:
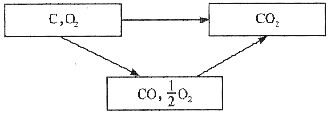
可知,反应C+O2=CO2反应机理为:①
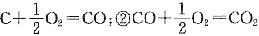 。
。
B.升高温度使反应速率增大,主要是因为分子碰撞频率增高;
C.反应H2(g)+I2(g)=2HI(g)的速率方程为v=k·c(H2)·c(I2),所以此反应为基元反应;
D.
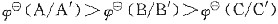 。标准状态下,反应A+C’=A’+C不一定先于A+B’=A’+B发生。
。标准状态下,反应A+C’=A’+C不一定先于A+B’=A’+B发生。
参考答案:D
解析:热力学中,处理状态函数的变化时,只考虑过程的初态和终态,途径可任意设定;而反应机理,指过程发生的具体途径,要通过实验来确定。故答案A不正确。升高温度使反应速率增大,是因为能量因子增高所致,故答案B不正确。由速率方程不能判断是否是基元反应,故答案C不正确。热力学判断反应自发,只是判断反应的可能性,实际能否发生、速率如何,必须考虑动力学因素,故答案D正确。
