问题
计算题
(6分)(2012•巴中)某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称量.得到实验数据如下.
| 稀H2SO4用量 | 剩余固体质量 |
| 第一次加入10.0克 | m |
| 第二次加入10.0克 | 5.4克 |
| 第三次加入10.0克 | 4.1克 |
| 第四次加入10.0克 | 2.8克 |
| 第五次加入10.0克 | 1.6克 |
| 第六次加入10.0克 | 1.6克 |
(2)该锌铜合金锌的质量分数为 _________ .
(3)计算所用稀H2SO4中溶质的质量分数.(请写出计算过程,结果精确到0.1%)
答案
(1)6.7g; (2)80%; (3)19.6%
(1)根据表格中的数据可分析出10克稀硫酸与1.3克锌恰好完全反应,则m的值为:8g﹣1.3g=6.7g;
故答案为:6.7g;
(2)因为铜不与硫酸反应,最后剩余的固体的成分是铜,所以锌铜合金中锌的质量为:8g﹣1.6g=6.4g
锌铜合金中锌的质量分数为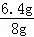 ×100%=80%; 故答案为:80%;
×100%=80%; 故答案为:80%;
(3)每10.0g稀硫酸与1.3g锌恰好完全反应
设10.0g稀硫酸中溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
1.3g x
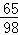 =
=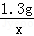 解得 x=1.96g
解得 x=1.96g
稀硫酸中溶质的质量分为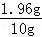 ×100%=19.6%.
×100%=19.6%.
