问题
计算题
(2012•铜仁市)烧杯中装有一定量盐酸和硫酸铜的混合溶液,已知该溶液中含HCl的质量为3.65g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量如下表所示:
| 加入NaOH溶液的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 生成沉淀的质量/g | 0.0 | 0.00 | 2.45 | 4.90 | 4.90 |
(1)最终得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g.
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程,保留小数点后面一位)
答案
(1)4.9;8;(2)80g
(1)根据图表中数据可知生成4.9g沉淀不再反应了,说明最多生成4.9g沉淀;设要生成4.9g沉淀需要参加反应的硫酸铜的质量为X,参加反应的氢氧化钠的质量为Y则:
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98
X Y 4.9g
根据: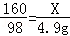 解得X=8g,根据:
解得X=8g,根据: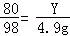 解得Y=4g
解得Y=4g
(2)设与氯化氢反应的氢氧化钠质量为Z则:
HCl+NaOH═NaCl+H2O
36.5 40
3.65g Z
根据: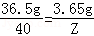 解得Z=4g,所以 氢氧化钠的质量总和为4g+4g=8g,所以参加反应的NaOH溶液的总质量是:
解得Z=4g,所以 氢氧化钠的质量总和为4g+4g=8g,所以参加反应的NaOH溶液的总质量是: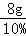 =80g
=80g
