某化学兴趣小组的同学在老师的带领下参观如图所示的炼铁厂。小新想用自己所学知识来测定产品中铁的质量分数,征得工人师傅同意,带回一小块生铁样品。称得该样品6.0g,放入烧杯中,向其中逐滴加入稀盐酸,当滴入54.0g稀盐酸时,反应不再产生气泡(假设杂质不参与反应),称得烧杯内剩余物质的总质量为59.8g。(铁与稀盐酸反应的化学方程式为Fe+2HCl=FeCl2+H2↑)
请你帮小新完成有关计算(结果保留一位小数):
(1)实验产生氢气的质量是 g。
(2)生铁样品中铁的质量分数。
实验中产生氢气的质量是0.2g,生铁样品中铁的质量分数是93.3%。
由质量守恒定律及化学方程式Fe+2HCl=FeCl2+H2↑可知反应前样品6.0g放入54.0g稀盐酸,反应后烧杯内剩余物质的总质量为59.8g,质量减少了6.0g+54.0g-59.8g=0.2g,为氢气的质量,将氢气的质量代入化学方程式Fe+2HCl=FeCl2+H2↑,就可计算出样品中铁的质量,即可计算出样品。
解:根据质量守恒定律可知:
生铁与酸反应时生成的氢气的质量是:6.0+54.0g-59.8g=0.2g
设生铁中铁的质量是x
Fe + 2HCl = FeCl2 + H2↑
56 2
X 0.2g
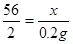 x=
x=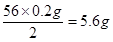
生铁中铁的质量分数是: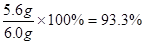
答:实验中产生氢气的质量是0.2g,生铁样品中铁的质量分数是93.3%。
