(2012•宁波)实验室中有一样品,已知是由氧化亚铁和氧化铜组成.小科把样品均分成两份,根据学过的知识进行如下实验:
步骤一:将其中一份样品加入过量盐酸得到溶液A;
步骤二:将另一份样品在加热条件下与过量一氧化碳充分反应得到粉末B;
步骤三:将溶液A、粉末B混合,结果产生无色气体0.5克,并得到不溶于物32克和不含Cu2+的强酸性溶液.
(1)溶液A的溶质中,除生成的氯化亚铁和氯化铜外,还含有 ;
(2)计算原样品中氧化铜的质量;
(3)计算粉末B中铁的质量;
(4)原样品中氧化亚铁和氧化铜的质量比为多少?
(1)HCl;(2)40g;(3)28g;(4)9:5
(1)步骤一中加入的盐酸是过量的,所以在反应后的溶液中还含有HCl;
(2)由于铁比铜活泼,可以和铜盐反应,而步骤三中得到的是不含Cu2+的强酸性溶液,说明铜已全部被铁置换出,而铁不能存在于强酸性的溶液中,从而可以判断32g不溶物全部为铜,根据铜元素的质量守恒,即氧化铜中的铜元素和反应后生成的铜的质量相等,可得:
32g÷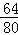 ×100%=40g;
×100%=40g;
答:原样品中氧化铜的质量为40g.
(3)设与盐酸反应的铁粉的质量为x,与氯化铜反应的铁粉的质量为y,
其中铁和氯化铜反应生成铜的质量为:32g÷2=16g
Fe+2HCl═FeCl2+H2↑ Fe+CuCl2═FeCl2+Cu
56 2 56 64
x 0.5g y 16g
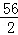 =
=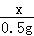
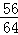 =
=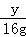
解得:x=14g 解得:y=14g
所以生成铁的质量为:14g+14g="28" g
答:粉末B中铁粉的质量为28g.
(4)根据铁元素的质量守恒可以求算出氧化亚铁的质量,B中含铁粉的质量为28g,即铁元素的质量为28g,则两份中含有的铁元素的质量为56g
56g÷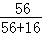 ×100%=72g;
×100%=72g;
72g:40g=9:5;
答:原样品中氧化亚铁和氧化亚铜的质量比为9:5.
