问题
填空题
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中加入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1) FeCl3蚀刻铜箔反应的离子方程式为______。
(2)过程Ⅰ加入铁屑的主要作用是______,分离得到固体的主要成分是从固体中分离出铜需采用的方法是Ⅰ。
(3)过程Ⅱ中发生反应的化学方程式为______。
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为______。(列式计算)
答案
参考答案:
(1)
(2)回收铜 Cu和Fe 加盐酸反应后过滤
(3)
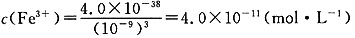
(4)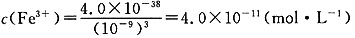
解析:
(1)Fe3+具有强氧化性,能将Cu氧化为Cu2+,即该反应的离子方程式为 。
。
(2)向废液中加入过量的铁屑,能将溶液中的Cu2+还原为单质铜,便于回收铜;过滤得到的固体的主要成分为生成的单质铜和未反应铁屑;可向该混合物中加入足量盐酸,使铁屑充分反应,过滤即可得到单质铜。
(3)滤液的主要成分为FeCl2,加入石灰水时发生的反应为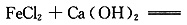 Fe(OH)2↓+CaCl2,鼓入足量空气时,Fe(OH)2被O2氧化为Fe(OH)3,即4Fe(OH)2+O2+
Fe(OH)2↓+CaCl2,鼓入足量空气时,Fe(OH)2被O2氧化为Fe(OH)3,即4Fe(OH)2+O2+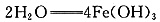 。
。
(4)当过程Ⅱ中溶液的pH=5时,溶液中c(OH-)=10-9mol/L,根据Ksp的表达式求得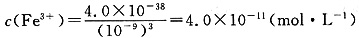 。
。
