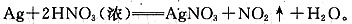有文献记载:在强碱性条件下,加热银氨溶液可能析出眼镜。某同学进行如下验证和对比实验。
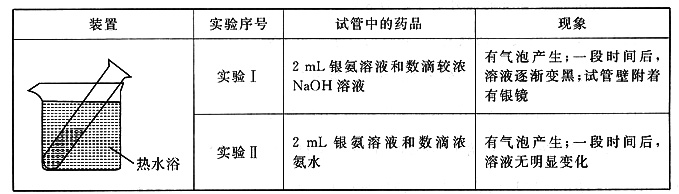
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅材料:
a.

b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是______。
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。
①用湿润的红色石蕊试纸检验NH3,产生的现象是______。
②产生Ag2O的原因是3。
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O。实验及现象:向AgNO3溶液中加入______,出现黑色沉淀;水浴加热,未出现银镜。
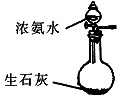
(4)重新假设:在NaOH存在下,可能是NH3还原Ag2O。用如图所示装置进行实验。现象:出现银镜。在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略)。

(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成。由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应。进行如下实验:
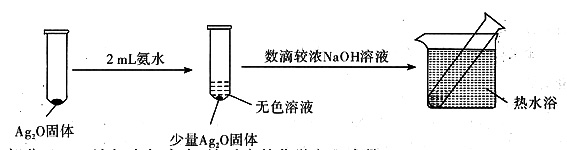
①有邵分Ag2O浴解在氨水中,该反应的化学方程式是______;
②实验结果证实假设成立,依据的现象是______。
(6)用HNO3清洗试管壁上的Ag,该反应的化学方程式是______。
参考答案:
(1)AgNO3溶液和氨水
(2)①试纸变蓝
②在NaOH存在下,加热促进NH3·H2O分解,逸出NH3,促使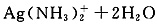
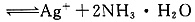 平衡正向移动,c(Ag+)增大,Ag+与OH-反应立即转化为Ag2O;
平衡正向移动,c(Ag+)增大,Ag+与OH-反应立即转化为Ag2O;

(3)过量NaOH溶液
(4)
(5)①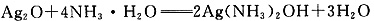
②与溶液接触的试管壁上析出银镜
(6)
解析:
(1)用硝酸银溶液与氨水配制银氨溶液;
(2)氨气溶于水,溶液呈碱性,使红色石蕊试纸变蓝色。
 ,在碱性条件下(加入氢氧化纳),加热促进一水合氨分解,有利于平衡:
,在碱性条件下(加入氢氧化纳),加热促进一水合氨分解,有利于平衡:
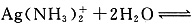 Ag++2NH3·H2O向右移动,使溶液中Ag+浓度增大,Ag+与OH-结合生成AgOH,AgOH分解生成Ag2O。
Ag++2NH3·H2O向右移动,使溶液中Ag+浓度增大,Ag+与OH-结合生成AgOH,AgOH分解生成Ag2O。
(3)硝酸银溶液与氢氧化纳溶液反应,出现黑色沉淀,不出现银镜,说明氢氧化纳不能还原氧化银。
(4)浓氨水与生石灰混合产生氨气,可以用固体体与液体在常温下生成气体的气体发生装置,用分液漏斗控制加入浓氨水的量和速率。
(5)氧化银溶于氨水:
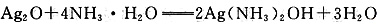 。如果水浴加热试管里的银氨溶液,会产生银镜,说明假设成立。
。如果水浴加热试管里的银氨溶液,会产生银镜,说明假设成立。
(6)Ag与HNO3反应的化学方程式为: