实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。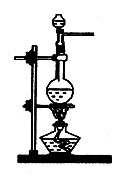
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是______(填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中的滴定法确定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定甲方案不可行,理由是______;
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样;
a.量取试样20.00mL,用0.1000mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为______mol·L-1;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果______(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
参考答案:
(1)ACB(按序写出三项)
(2)①残余清液中,n(Cl-)>n(H+)(或其他合理答案)
②0.1100
③偏小
解析:
(1)注意实验操作的规范性;正确的操作顺序为ACB。
(2)①甲方案中加入足量AgN03溶液,产生AgCl白色沉淀。反应后的残余液中溶质主要为MnCl2和HCl,故不能用来测定残余液中盐酸的浓度。②由酸碱中和滴定的量关系可得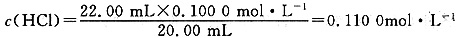 。③由MnCO3、CaCO3的Ksp数值可知,加入CaCO3,CaCO3不仅与残余液中的盐酸反应,还会生成MnCO3沉淀,使测定结果偏小。
。③由MnCO3、CaCO3的Ksp数值可知,加入CaCO3,CaCO3不仅与残余液中的盐酸反应,还会生成MnCO3沉淀,使测定结果偏小。
