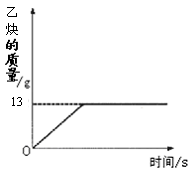
(10分)乙炔(C2H2)是一种重要化工原料,实验室常用碳化钙(CaC2)与水反应制取。某化学兴趣小组取一定质量的碳化钙与90g水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)碳化钙(CaC2)与水反应的化学方程式为:CaC2 + 2H2O = + C2H2↑。其中X是一种碱,则X的化学式为 ;
+ C2H2↑。其中X是一种碱,则X的化学式为 ;
(2)碳化钙中Ca、C元素质量比为 ;
(3)反应过程中生成乙炔的质量为_______g;
(4)取用碳化钙的质量为多少?
⑴ Ca(OH)2(1分) ⑵ 40:24(2分) ⑶13(2分) (4)32g
(1)根据质量守恒定律的元素守恒,可推测X的化学式;⑵根据碳酸钙的化学式为CaCO3,利用相对原子质量来计算元素的质量比(3)由图可知反应过程中生成乙炔的质量为13 g,(4) 根据方程式利用乙炔气体的质量可求出需要碳化钙的质量.
(4)设碳化钙的质量为x。……(1分)
CaC2 + 2H2O =Ca(OH)2 + C2H2↑……(1分)
64 26
x 13g……(1分)
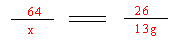 ……(1分)
……(1分)
解之得:x=32g……(1分)
答: 取用碳化钙的质量为32g。(解和答全对给1分,若有错误给分。)
