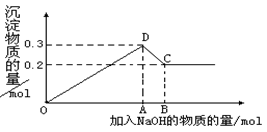
(16分) 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。则:
(1)写出代表各线段发生反应的离子方程式:
OD段 , _________________________________,
DC段 _。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经转化为 Mg2+已经转化为 。
(4)图中线段OA∶AB= 。
(共16分)
(1)Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓ ;
Al(OH)3+OH-=AlO2-+2H2O每个2分共6分
(2)2∶1(2分)
(3)0.8 (2分) 全部溶解生成NaAlO2、(2分)完全生成沉淀Mg(OH)2,(2分)
(4)7∶1 (2分)
题目分析:(1)MgCl2和AlCl3的混合溶液中,开始加入氢氧化钠,生成的是氢氧化镁和氢氧化铝沉淀,沉淀达到最高点时,镁离子、铝离子完全沉淀,此时沉淀为0.3mol,反应如下:
Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓ ;
继续加入氢氧化钠,会与氢氧化铝反应,沉淀溶解,反应如下:
Al(OH)3+OH-=AlO2-+2H2O
(2)根据从D到C,沉淀减少量为0.1mol,知道n(Al(OH)3)=n(AlCl3)=0.1mol,n(Mg(OH)2)= n(MgCl2)=0.3-n(Al(OH)3)=0.2mol;则n(Mg2+):n(Al3+)=2:1;
(3)根据方程式计算
Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓ 、Al(OH)3+OH-=AlO2-+2H2O
0.2mol 0.4mol 0.1mol 0.3mol 0.1mol 0.1mol
加入的n(NaOH)=0.4+0.3+0.1=0.8mol时,Al3+已经转化为NaAlO2,Mg2+已经转化为沉淀Mg(OH)2。
(4)根据上述的方程式计算,到D点时加入的氢氧化钠为0.7mol,从D到C加入的氢氧化钠为0.1mol,所以为7:1。
点评:通过方程式结合图像进行化学方程式计算考查学生的分析能力及观察能力,综合性较强,难度较大。