硝酸钾是农业上常用的一种化肥,能够使农作物枝叶繁茂、增强抗倒伏、抗病虫害的能力,硝酸钾属于化肥中的 。硝酸钾与任何酸、碱、盐都不会发生复分解反应,其原因是 。
(1)为了探究硝酸钾固体在水中溶解质量多少的影响因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论。
实验一: KNO3在20℃水中达到饱和时溶解的质量
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
实验二:KNO3在20g水中达到饱和时溶解的质量
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有 (写一种)。
(2)如图所示,小烧杯中盛放的是硝酸钾饱和溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是_____________(填字母)。
A. 冰块 B. 浓硫酸 C. 硝酸铵 D.氢氧化钠 E. 氧化钙
(3)请填充表中空白并根据下列实验和上述有关信息回答问题:(已知水的密度约为1g/cm3)
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20°C | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20°C | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20°C | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20°C | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20°C | 析出晶体b | 得溶液⑥ |
(4)将10ml98%浓硫酸(密度为1.82 g/ ml)中加水稀释至100ml,取10ml该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
①10ml98%的浓硫酸中含 g H2SO4。(不需要写出计算过程)
②列式计算消耗金属锌的质量。
复合肥 钾盐、硝酸盐都易溶于水或不可能生成沉淀、气体或水
(1)实验一:温度 实验二:温度越高,溶解KNO3的质量越多 气体的压强(或气体的性质)
(2)A C
(3)①; ②③⑤; 3.16g
(4)① 18.0 ②1.2g
含氮、磷、钾中的一种的肥料分别是氮肥、磷肥、钾肥,若含氮、磷、钾中的两种或两种以上的肥料则是复合肥,因硝酸钾中含营养元素中的氮和钾两种元素,故为复合肥;
根据复分解反应发生的条件:生成沉淀、气体或水可知,硝酸钾中的离子是钾离子和硝酸根离子,而钾盐、硝酸盐都易溶于水,不可能生成沉淀、气体或水;
(1)根据控制实验变量的原理(即“只改变某一个实验变量而控制其它变量不变,从而获得该变量对实验结果的影响”),实验一是控制温度相同,探究改变水的质量对溶解KNO3的质量的影响;实验二是控制水的质量相同,探究改变温度对溶解KNO3的质量的影响.如果是气体物质,除上述因素(温度、水的质量)外,影响其在水中溶解质量多少的因素还有气体的压强(外因)和气体的性质(内因).
故答案为:实验一:温度;实验二:温度越高,溶解KNO3的质量越多;气体的压强(或气体的性质).
(2)通过改变温度使硝酸钾晶体析出,因为硝酸钾的溶解度随温度的升高而增大,故A.冰块溶解吸热会使溶液的温度降低,C.硝酸铵溶于水会吸收热量是溶液的温度降低,二者都可以间接使硝酸钾通过降温而结晶析出.故答案为:AC.
(3)步骤1后加入Wg硝酸钾后才恰好饱和,说明溶液①为不饱和溶液;步骤2恰好饱和,故为饱和溶液;步骤3是在步骤2的基础上继续加溶质,不能继续溶解,故为饱和溶液;步骤4只是加热,看到全部溶解,可能是饱和溶液,也可能是不饱和溶液;步骤5又降温到20℃,有晶体析出,故为饱和溶液;步骤6蒸发掉10g水,恢复至20°C,又有晶体析出,故仍为饱和溶液;又因为②③⑤⑥的溶液都是20℃时的硝酸钾饱和溶液,溶解度相等,故溶质质量分数也相等.由20℃硝酸钾的溶解度为31.6g,故当由饱和溶液⑤蒸发10g水,有析出晶体b后仍为饱和溶液⑥,故在20℃将晶体b溶解在10g水中,则恰好为饱和溶液,20℃硝酸钾的溶解度为31.6g,则b应为31.6g/100g×10g=31.6g.故答案为:①;②③⑤⑥;31.6g.
(4)①1.82 g/ ml×10ml×98% = 18.0 g
②解:设10ml稀硫酸与锌完全反应消耗锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
x 18.0g×10/100 (1分)
列式解之: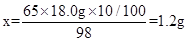 (1分)
(1分)
答:消耗金属锌的质量为1.2g.
