(12分)(2012•茂名)兴趣小组为了测定“碳还原氧化铜”实验中所用的氧化铜样品中的CuO含量,进行如下实验:用过量的稀盐酸溶解5g样品(杂质不与盐酸反应且不溶于水),过滤,取100g滤液,向其中加入NaOH溶液,所得实验数据如图:
(1)从图可知,加入的NaOH先跟滤液中 _________ 反应,后跟 _________ 反应.(写化学式)
(2)该样品中CuO的质量是 _________ .
(3)计算所加氢氧化钠溶液中溶质的质量分数.(写出计算过程)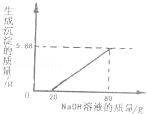
(1)HCl;CuCl2;(2)4.8g;(3)答:氢氧化钠溶液中溶质的质量分数为8%
(1)氢氧化钠放入后开始并没有沉淀产生,所以加入的NaOH先跟滤液中的盐酸反应再和溶液中的氯化铜反应生成氢氧化铜的沉淀;
(2)依据方程式CuO+2HCl═CuCl2+H2O和CuCl2+2NaOH═Cu(OH)2↓+2NaCl可知每个氧化铜的分子最终可以生成1个氢氧化铜分子,所以可建立关系式CuO~Cu(OH)2;
设样品中氧化铜的质量是x
CuO~Cu(OH)280 98
x 5.88g
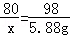
x=4.8g
(3)设与氯化铜反应的氢氧化钠的质量是y
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
80 98
y 5.88g
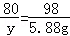
y=4.8g
所以氢氧化钠溶液中溶质的质量分数=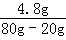 ×100%=8%
×100%=8%

