为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式
;
(3)所用稀盐酸中溶质的质量分数为多少?
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为多少?
(5)黄铜样品中铜的质量分数为多少?
(1)Zn+2HCl=ZnCl2+H2↑
(2)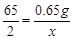 [或65:2=(9.10g-8.45g):x]
[或65:2=(9.10g-8.45g):x]
(3)7.3%
(4)8g
(5)80%
(1)锌在金属活动顺序表中位于氢之前能把盐酸中的氢置换出来,反应的化学方程式为Zn+2HCl═ZnCl2+H2↑;
(2)第二次加入10g盐酸,导致固体由9.10g变成了8.45g,第三次也是有8.45g变成7.80g,说明每加入10g盐酸能够使固体减少0.65g.所以第二次加入盐酸消耗锌的质量=9.10g-8.45g=0.65g,则有:
Zn+2HCl═ZnCl2+H2↑
65 2
0.65g x
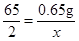
(3)设10g稀盐酸中HCl的质量为y
Zn+2HCl═ZnCl2+H2↑
65 73
0.65g y
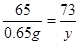 解得y=0.73g
解得y=0.73g
所用稀盐酸中溶质的质量分数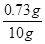 ×100%=7.3%
×100%=7.3%
(4)需要浓盐酸的质量=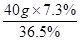 =8g
=8g
(5)由第二次实验可知,第一次加入10g稀盐酸时,反应消耗锌的质量为0.65g,则原黄铜样品的质量=9.10g+0.65g=9.75g;由第四次实验可知,样品中铜的质量7.80g
黄铜样品中铜的质量分数=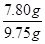 ×100%=80%
×100%=80%