问题
计算题
(8分)将25克石灰石 (杂质不溶于水,也不与酸反应)放入烧杯中,恰好与100克稀盐酸完全反应,生成8.8克二氧化碳。试计算:(1)原样品中碳酸钙的质量分数;(2)原稀盐酸中溶质的质量分数。
答案
(1) 80% (2)14.6%
利用二氧化碳的质量,根据反应的化学方程式,分别计算恰好完全反应时碳酸钙的质量和HCl的质量,最后使用质量分数的计算公式,求出样品中碳酸钙的质量分数和所用盐酸的质量分数
解:设石灰石中碳酸钙的质量为x 。盐酸中HCl的质量为y------(1分)
CaCO3+2HCl= CaCl2 +H2O +CO2↑ (2分)
100 73 44
x y 8.8g (1分)
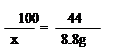
解得: x = 20g (1分)
则碳酸钙的质量分数=20 g /25 g×100% =80%(1分)
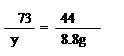
Y=14.6g (1分)
盐酸中的溶质质量分数为:14.6g/100g ×100% =14.6%(1分)
