问题
计算题
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用于制作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
| 第1次 | 20 | 17.4 |
| 第2次 | 20 | 14.8 |
| 第3次 | 20 | 12.2 |
| 第4次 | 20 | 12.0 |
| 第5次 | 20 | m |
(1)上述表格中m的值为 (1分);
(2)黄铜样品中锌的质量分数为 (2分);
(3)所用稀硫酸中硫酸的质量分数是多少?(请写出计算过程)(3分)
答案
(1)12 (1分) (2)40% (2分)(3)19.6%
题目分析:(1)由表中数据可知,每加入20g稀硫酸,都将反应2.6g锌,到第4次的时候,固体只减少了0.2g,说明此时锌已经全部反应完了,故第5次加入硫酸,固体质量不会改变,所以m=12g。
(2)黄铜样品中锌的质量分数为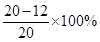 =40%;
=40%;
(3)与20g稀硫酸完全反应的锌的质量 = 20g-17.4g=2.6g
解:设,20g稀硫酸中H2SO4的质量为x。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
2.6g x
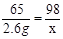
x=3.92g
所用稀硫酸中溶质的质量分数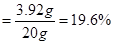
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
溶质质量分数=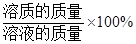 。
。
